- TOP
- イノベーションのDNA
- 難攻不落のD-アミノ酸分析 発想の転換で突破口を開く 「キラル」に挑んだ分析屋(後編)
イノベーションのDNA

-
#分析化学 #キラル分離 #モニタリング・診断 #認知症 #超高齢化社会
【特集:認知症の早期発見-解析科学】
難攻不落のD-アミノ酸分析 発想の転換で突破口を開く
「キラル」に挑んだ分析屋(後編)
-
2021/10/13 Text by 堀川晃菜

分析化学は、化学の分野の中でも、化学メーカーの中でも、おそらく花形とは呼ばれない。どちらかと言えば地味……と言ったら怒られるかもしれないが、何かを合成して、それができているかを確かめたり、不純物が含まれていないか調べたりする時に出番が多い。だが一方で、科学の歴史を塗り替えてきたのもまた、分析化学と言える。
「分析化学は、縁の下の力持ちであるだけでなく、宇宙から生物まであらゆる自然を対象に新しい物質の存在を知らせることで、やがて私たちの常識や生活を変える可能性を秘めています」
そう話すのは、血中にごく微量しか存在しないD-アミノ酸の短時間解析を実現し、D-アミノ酸と認知機能の相関を示すことに貢献した花王 解析科学研究所の木村錬研究員だ。木村研究員らが挑んだのは、分析技術の中でも難関と言われるアミノ酸の鏡像異性体(キラル)の分離。従来法では15時間を要するところ、わずか20分でその網羅解析を可能にした。そこには木村研究員らの執念と、職人の勘、そして発想の大転換があった。
前編はこちら:「認知症の早期診断へ 血中アミノ酸分析の凄すぎる新技術」
プレスリリース:認知機能の評価指標として血中D-アミノ酸が有用であることを発見

-
辻村 久(つじむら ひさし)/左
花王株式会社 解析科学研究所 上席主任研究員。グループリーダー。花王高等専修学校卒 1993年 花王に入社。クロマトグラフィーを主とする分離技術を用いた生体成分・微量成分解析に従事。これまでに界面活性剤やセラミド、皮脂などの網羅解析技術を確立してきた。
木村 錬(きむら れん)/右
花王株式会社 解析科学研究所 研究員。北海道大学では分析化学を専攻。2015年、花王に入社。入社以来、食品・生体微量成分解析に従事。「何が、どこに、どれだけあるか」を分析化学で徹底的に調べ上げ、新領域創造を目指す。近年ではキラルメタボロミクス(D-アミノ酸)による認知症研究に注力。
なぜキラルアミノ酸は難しいのか
ヒトのタンパク質を構成するアミノ酸は全部で20種類ある(よく聞くものでは、システインやグルタミン酸など)。さらに、それぞれのアミノ酸にはキラルが存在し、例えばシステインでもD-システインとL-システイン、つまりD体とL体の二つがある。つまり、血中のキラルアミノ酸を分離するには、次の2つの作業をしなければならない。
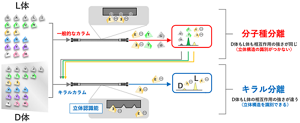
(1)20種類の種類別に分ける:「分子種分離」
(2)それぞれのアミノ酸をD体とL体に分ける:「キラル分離」
-
図1:アミノ酸の網羅解析には、異なる2種(分子種・キラル)の分離が必要
だが、ものぐさな筆者はこう思ってしまう。「認知症と関連がありそうなものだけ、調べればよいのでは」。前編でも紹介したように、今回の研究が始まるより前に、認知症の発症メカニズムとの関連が指摘されていたアミノ酸は、D-セリンのみ。脳と髄液でその変動が捉えられており、D-セリンが増えることで神経伝達の調節異常を起こすと考えられている。
もし、より簡便に血液からD-セリンを検出することを目指すのであれば、セリンだけを抽出して、L体とD体に分ければ良い。しかし当時、解析科学研究所で第2研究室長を務めていた土屋勝氏は「認知症についてはまだ分かっていないことが多く、早期診断を実現したいというのはもちろんですが、新たなメカニズムの解明につながるような物質、現象を見つけたい意図もありました。そこで取り組んだ全キラルアミノ酸種の網羅解析という難しい挑戦を支えたのは、これまで独自の分析技術を開発し、花王の生体研究領域を拡げてきた辻村グループリーダーです」と話す。
結果、見事その狙い通り、木村研究員らは早期診断の礎を築くだけでなく、認知機能と相関性のある物質としてD-プロリンを新たに発見することができた。では、この高い技術目標をいかにして実現したのだろうか。
クロマトグラフィーを効率化せよ
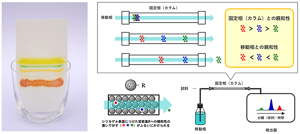
複数の物質が混在する試料から一つひとつの物質を分離する際に用いられるのがクロマトグラフィーという手法だ。一番わかりやすいのは、インクの付いた紙に水を吸わせると、インクの成分がグラデーション状に広がっていく現象(下の写真)。このときインクを染み込ませた紙は「固定相」、そこに流れ込む水は「移動相」の役割を果たし、インクの成分を分離している。
-
図2:クロマトグラフィーの原理
このように移動相が対象の混合物を溶かして運び、固定相が移動してきた成分を分けるのが、クロマトグラフィーの基本原理だ。固定相のことを「カラム」と呼ぶのでカラムクロマトグラフィーとも呼ばれる。固定相はその表面や内部で物質をキャッチする。この時に、物質の大きさ、吸着力、電荷、質量、疎水性などの違いを利用して成分ごとに分離する。
つまり分離したい物質によって、固定相と移動相の組み合わせを変えていくのが、分析屋の腕の見せ所だ。だが、今回の分析対象である20種類のアミノ酸は、分子量や電荷などの性質もばらばらで、その上キラル分離もしなければならない。通常の分子種を分けるカラムでは立体識別ができないため、別にキラル分離用のカラムも必要となる。
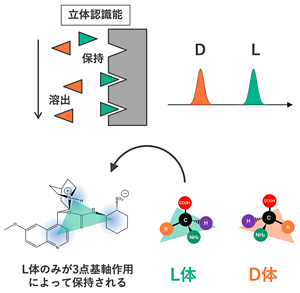
-
図3:キラルカラムによる鏡像異性体の識別(概念図)
「従来は分子種を一つずつ分離し、さらにそれをまた一つずつキラルカラムにかけるという非常に煩雑な作業が必要でした。その後、手作業ではなく全自動で分子種分離とキラル分離を切り替えながら行う2次元LC(LC:Liquid chromatography)という手法が開発されました。それでも全キラルアミノ酸の分析には15時間かかり、認知症のリスク診断技術とするにはハードルがあったというのが我々の認識です」(木村氏)
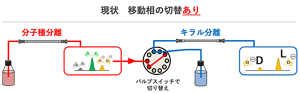
2次元LCでは流路を切り替えるバルブを介して、分子種分離カラムと、キラル分離カラムをつないでいる。この場合は1本目で分子種分離を行い、その溶出液がバルブのループに溜まるとバルブを切り換え、順次2本目でキラル分離していく。
この手法では、前提として1本目と2本目のカラムで移動相に使用する溶液が異なるため「切り替え」(スイッチ)が不可欠だ。また、ループの数には限りがあるので一巡目だけで20種のアミノ酸を取り出せないという問題もあった。結局1つずつカラムを切り替えながら、それを何巡か繰り返すと15時間かかった。
大胆すぎる作戦!理想のカラムを追い求め
そこで、木村研究員は「切り替えをなくそう」と考えた。しかも「理想的には、1本のカラムで分子種もキラルも両方分離できたら……」という、なんとも大胆な発想だった。
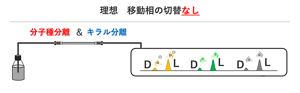
(木村さんはいたって真面目にそう言うが、素人ながらそれはちょっと無謀じゃないかと思ってしまう。だがFRaUの記事で紹介するように認知症患者が身近な存在であり、大学時代からクロマトグラフィーなどの分析技術を究めてきた木村さんにとって、これは大きな挑戦であり、真剣そのものだった。)
木村研究員の最初の戦略は「キラルカラムで分子種も一気に同時分離する」というものだ。前述の通り、分子種カラムでキラルは分離できない。だが、近年急速に開発が進むキラルカラムの中には、複雑な構造を有するカラムが多数、登場している。水素結合や配位結合、イオン性相互作用や親疎水性相互作用など、キラルの分離機構も多様化しているのだ。そこで、木村研究員は通常はキラル分離にのみ用いられるキラルカラムを、アミノ酸の修飾基(側鎖)の構造によっては分子種分離にも応用できるのではないかと考えた。
そこで木村研究員は、分離機構の異なる15種類以上のキラルカラムと、移動相に用いる5種類以上の溶媒の組み合わせを試していった。だが、いきなり壁にぶち当たる。なんとキラルカラムなのに、キラルアミノ酸がうまく分離できなかったのだ。
「実はキラルカラムといっても、実際に試してみると明瞭にアミノ酸でキラル分離を達成できるものは少なく、まさかキラル分離で苦戦するとは思いもしませんでした。その中でも唯一、両性イオン型のキラルカラムで移動相にメタノールを用いると、ようやくD体とL体を明瞭に分けるという分析条件を見つけることができました」(木村氏)
だが残念ながら、この両性イオン型キラルカラムでは、分子種分離ができなかった。それならば、通常の分子種分離カラムでメタノールが使えればよいのだが、それも難しい。分子種分離カラムでは、多量の添加剤を含んだ緩衝液や、アセトニトリル系の移動相でなければならないからだ。
思わぬ形でキラルカラムの選択肢が一気に狭められ、分子種分離の同時達成は一気に困難を極めた。だが、木村研究員はここで諦めなかった。両性イオン型以外のキラルカラムを分子種分離の視点から再検証したのだ。
執念が生んだミラクル
クロマトグラフィーにおいては固定相(カラム)と移動相の相性が最も重要だが、それ以外にも温度や移動相の流量、サンプルの注入量、カラムの内径、添加剤などを調整することで、よりシャープに分離できるよう制御している。分析屋の職人技といったところだ。
こうした条件も含め、数百以上の検討を続け、ついに木村研究員は(キラム分離はできないが)分子種分離ができるというキラルカラムにたどり着いた。それがカチオン(陽イオン)型のカラムだ。それも、メタノールを移動相に用いることができた。
当初、理想とした1本のカラムではないものの、移動相をメタノールで揃えられたことにより、何よりネックだった切り替えが不要となった。この2本のキラルカラムを連結し、最終的に温度や流量などの諸条件を最適化したことで、見事に20種類全てのアミノ酸において、分子種分離とキラル分離を同時に達成した。
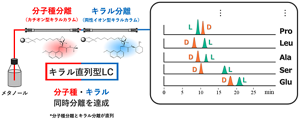
こうして「キラルカラムで分子種分離ができる」という新発見がブレイクスルーとなり、花王独自のキラルアミノ酸一斉解析技術が誕生した。解析時間は約20分と大幅に短縮され、実際に血液中にごく微量しか存在しないD-アミノ酸の検出に成功。認知機能と相関のあるD-セリン、D-プロリンの特定に至った(詳しくは前編)。現在、この技術を基盤として、認知症早期スクリーニング検査への応用に向けた臨床研究が進んでいる。
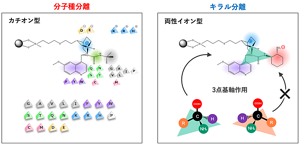
ただ実のところ、なぜキラルカラムで分子種分離ができたのか、詳しい理由は完全に解明されていない。
「一般にアミノ酸の分子種分離ではイオン性相互作用がカギとなります。今回はカチオン型カラムにプロトン(H+)を供与するメタノールを流したことでプラス同士の反発が生まれ、マイナス電荷のアミノ酸はより引き寄せ、プラスが強いほど溶出しやすいといった電気的な作用がうまくはたらいたのではないかと考えています(図中の青色部分)。さらに詳細にクロマトグラムを検討すると、カラムが有するさまざまな相互作用が複合的に寄与していることが推測されます。例えば、メトキシキノリル基由来のπ-π相互作用(紫)、アミド由来の双極子相互作用(緑)など、それぞれがアミノ酸の側鎖(R)の特性に対応すると考えられます。そういう意味でキラルカラムは当初の期待を裏切りませんでした」(木村氏)
分析技術で新たな世界を切り開く
現在、花王は他企業や専門機関、行政と連携しながら認知症の早期診断・モニタリングの実現を目指して社会実装に取り組んでいる。「日本中から最先端の知見を結集して、社会の仕組みを変えていきたいと思っています。今は誰もが認知症になるかもしれない時代ですが、自覚症状が現れる前の早期診断を実現することで認知症にならずに済む社会をつくりたい」と木村研究員は語る。

基盤技術のブラッシュアップも続いている。分析時間のさらなる短縮を目指し、カラム1本で完結させる道もまだ諦めていない。また、タンパク質の構成要素以外にも体内には多種多様なアミノ酸がある。実は今回開発した解析技術を用いれば、シトルリンやオルニチンといった特異な生理作用で注目されているアミノ酸についても同様の分離が可能なことを確認しており、分子種の対象も広げていきたい考えだ。
「分析屋としては、新しい分析方法だからこそ、新しい本質が見えてくるという信念があります。私たちの体にも、まだ見つけられていないD-アミノ酸があると思っています」。
科学的には、宇宙にはD体とL体のアミノ酸は半々ずつ存在するのに、地球上の生物が利用するのはL体に偏っているという大きな謎も残っている。私たちがまだ見ぬ世界を切り拓くのは、分析屋の技術と情熱かもしれない。
powered by ブルーバックス
<参考文献>
・分析化学について
「すべて分析化学者がお見通しです! 薬物から環境まで微量でも検出するスゴ腕の化学者」津村ゆかり、立木秀尚、高山透、堀野善司(技術評論社)ISBN-13 : 978-4774145525
「図解入門よくわかる最新分析化学の基本と仕組み 第2版」津村ゆかり(秀和システム)ISBN-13 : 978-4798046501
日本分析化学会HP https://www.jsac.jp/
- TOP
- イノベーションのDNA
- 難攻不落のD-アミノ酸分析 発想の転換で突破口を開く 「キラル」に挑んだ分析屋(後編)






